I CARBOIDRATI
Le molecole organiche presenti negli organismi viventi e rispettive funzioni
Le biomolecole sono divisibili in quattro classi fondamentali:
- carboidrati
- lipidi
- proteine
- acidi nucleici.
Tutte le biomolecole, ad
eccezione dei lipidi, sono polimeri, ossia lunghe catene costituite dall’insieme di più monomeri (unità).
Ogni classe di biomolecole svolge specifiche funzioni:
·
I carboidrati
svolgono funzioni energetiche, di riserva e strutturali
·
I lipidi
costituiscono una riserva energetica e svolgono una funzione strutturale
·
Le proteine
svolgono molti ruoli biologici fondamentali nel metabolismo cellulare; sono
costituite da unità strutturali ripetute, dette amminoacidi
·
Gli acidi
nucleici sono le biomolecole polimeriche nelle quali sono codificati i geni e, pertanto, sono responsabili della conservazione, della trasmissione e dell'espressione
dell’informazione ereditaria; sono formati da unità strutturali ripetute,
chiamate nucleotidi.
I CARBOIDRATI
I carboidrati sono
biomolecole costituite da due o più gruppi idrossido (-OH) e da un gruppo
aldeidico (-CHO) o un gruppo chetonico (C=O).
I carboidrati svolgono
ruoli energetici (glucosio, fruttosio), di riserva energetica (amido e
glicogeno presenti nei vegetali e negli animali) e strutturali (cellulosa e
chitina).
In base alla complessità
della loro struttura, i carboidrati sono classificati in:
·
monosaccaridi
·
oligosaccaridi
·
polisaccaridi.
Le tre classi di
carboidrati sono in relazione tramite la reazione di idrolisi, ossia per
addizione di acqua in presenza di un catalizzatore acido H+:
I monosaccaridi
sono carboidrati che, per idrolisi, non sono suddivisibili in composti più
semplici.
I monosaccaridi vengono
distinti:
1.
A seconda che
contengano un gruppo aldeidico o chetonico in aldosi e chetosi (il gruppo aldeidico
si trova sull’estremità della catena, mentre quello chetonico all’interno)
2.
A seconda del
numero di atomi di carbonio presenti nella loro molecola possono essere
ulteriormente classificati in triosi (3 atomi di C), tetrosi (4 C), pentosi (5
C), esosi (6 C) ed eptosi (7 C). L’aldoso e il chetoso più semplici sono due
triosi: 2,3-diidrossipropanale o gliceraldeide e il diidrossipropanone o
diidrossiacetone.
I monosaccaridi più noti e
più diffusi sono il ribosio (presente nell’RNA) e il desossiribosio (presente
nel DNA), il glucosio (lo zucchero per eccellenza), il galattosio (lo zucchero
del latte) e il fruttosio (lo zucchero della frutta).
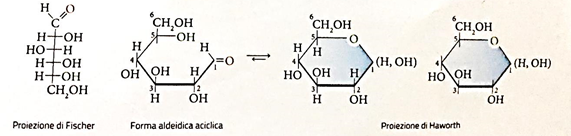
La chiralità: proiezioni di Fischer
Le molecole dei
monosaccaridi, tranne il diidrossiacetone, hanno due o più stereocentri: per questo
motivo i monosaccaridi sono definiti molecole chirali.
Per la presenza di uno
stereocentro la griceraldeide presenta due enantiomeri: uno destrogiro (+) e
uno levogiro (-).
D -
(+)-gliceraldeide L - (-)-gliceraldeide
Nel 1881 il chimico Emil
Fischer propose di rappresentare le formule dei due enantiomeri con formule
planari, dette in suo onore proiezioni di Fischer (o proiezione di Fischer-Tollens o formula proiettiva di Fischer) , in cui lo stereocentro viene
identificato dall’intersezione di due segmenti perpendicolari.
Per rappresentare i
monosaccaridi con le proiezioni d Fischer si deve:
1.
disporre la
catena carboniosa verticalmente con in alto il gruppo carbonile;
2.
omettere il
simbolo dell’atomo di carbonio che è uno stereocentro;
3.
numerare gli
atomi di carbonio dall’alto verso il basso.
La convenzione di Fischer è
estesa a tutti i monosaccaridi:
·
se lo
stereocentro più lontano dal gruppo aldeidico o chetonico ha l’ossidrile a
destra, si dice che il composto è un monosaccaride appartenente alla serie D
(in quanto l’OH è localizzato dallo stesso lato della D-gliceraldeide),
indipendentemente da come ruota il piano della luce polarizzata;
· se la configurazione dello stereocentro più
lontano ha l’ossidrile a sinistra, il composto è un monosaccaride della serie
L.
Per una molecola che
contiene n stereocentri, il numero
totale degli isomeri ottici è dato dalla formula 2n.
I monosaccaridi possono avere una struttura
ciclica
In acqua la struttura
prevalente dei monosaccaridi è ciclica ed emiacetalica. In soluzione acquosa,
infatti, il gruppo carbonile delle
aldeidi e dei chetoni reagisce velocemente con il gruppo ossidrile degli alcoli
portando alla formazione di emiacetali, secondo la reazione:
Nei monosaccaridi la
reazione tra i due gruppi, carbonile e ossidrile, conduce alla formazione di
una struttura emiacetalica ciclica. La forma aperta e quella ciclica sono in
equilibrio fra loro, ma l’equilibrio è spostato verso la forma ciclica, più
stabile. La produzione dell’emiacetale è infatti una reazione sfavorita.
I monosaccaridi riescono a
mantenere la struttura emiacetalica con la ciclizzazione.
Negli aldoesosi (es. il D-glucosio)
l’anello è ottenuto per addizione nucleofila del gruppo ossidrile del C-5 al
gruppo aldeidico in posizione C-1 ed è costituito da cinque atomi di carbonio e
da uno di ossigeno.
Proiezioni di Haworth
La forma ciclica degli
aldosi è un anello esatomico ed eterociclico che si rappresenta con le
proiezioni di Haworth, in cui l’atomo di ossigeno è posto in alto a destra
dell‘anello, mentre gli atomi di carbonio sono numerati e disposti in senso
orario a partire dal C-1 a destra.
Gli ossidrili stanno sotto
il piano dell’anello nelle proiezioni di Haworth, mentre gli ossidrili di
sinistra delle proiezioni di Fischer stanno sopra nelle proiezioni di Haworth. Il
gruppo terminale –CH2OH sta sopra nelle proiezioni di Haworth negli
aldoesosi della serie D e sotto in quelli della serie L.
Nel caso del D-glucosio:
Nei chetoesosi la forma
ciclica, ottenuta per addizione nucleofila del gruppo ossidrile del C-5 al
gruppo chetonico in C-2, è costituita da quattro atomi di carbonio e da un
atomo di ossigeno e, quindi, l’anello è pentatomico ed eterociclico.
Nel caso del D-fruttosio:
Anomeria e mutarotazione
La ciclizzazione dei
monosaccaridi porta alla formazione di un atomo di carbonio emiacetalico.
Il carbonio emiacetalico,
che nella forma aldeidica o chetonica non è uno stereocentro, nella struttura
ciclica lo diventa, essendo legato a quattro gruppi diversi. Questo atomo di
carbonio, emiacetalico e stereocentro, viene detto carbonio anomerico. In conseguenza del nuovo
stereocentro è possibile descrivere due stereoisomeri, detti anomeri, distinti
in α e β a seconda della posizione del gruppo ossidrile. Per i monosaccaridi
della serie D il gruppo OH è diretto:
·
verso il basso nell’anomero α
·
verso l’alto in quello β.
I due stereoisomeri α e β del glucosio hanno proprietà
fisiche diverse (la temperatura di fusione e la rotazione ottica specifica). I
due anomeri costituiscono una coppia di diastereoisomeri
(isomeri configurazionali che non sono sovrapponibili e non
sono enantiomeri perché le due strutture sono identiche,
ma differiscono solo nella
configurazione di un solo stereocentro (C-1) o
diastereomeri.
Le due forme α e β del D-glucosio in acqua si convertono
l’una nell’altra. Quando l’α-D-glucosio viene posto in acqua,
la rotazione ottica specifica diminuisce da +112° a +52°. Se, invece, è il
β-D-glucosio a essere messo in soluzione, la rotazione ottica specifica aumenta
da +19° a +52°.
La variazione di rotazione ottica associata
all’interconversione degli anomeri si chiama mutarotazione. Il fenomeno si giustifica con la reversibilità del
processo di formazione degli emiacetali. In acqua la forma ciclica emiacetalica α o β si apre per dare
l’aldeide aciclica, che poi ciclizza di nuovo per dare la forma α o β, fino al
raggiungimento di un equilibrio tra le due forme.
Le reazioni dei monosaccaridi sono ossidazione e
riduzione
Per la presenza dei gruppi
aldeidico e chetonico, i carboidrati danno reazioni di riduzione e ossidazione
tipiche del gruppo carbonile.
La reazione di riduzione
interessa il gruppo carbonile degli aldosi e dei chetosi nella forma aciclica,
in equilibrio con l’emiacetale ciclico. In presenza di un riducente, il gruppo
carbonile si riduce, e il prodotto che si ottiene è un poliolo, detto alditolo.
La reazione di riduzione
del D-glucosio porta alla formazione del D-glucitolo (sorbitolo).
Man mano che la forma
ciclica viene ridotta l’equilibrio si sposta a destra così che tutto il monosaccaride viene convertito in poliolo.
La reazione di ossidazione
interessa il gruppo aldeidico degli aldosi nella forma aciclica, in equilibrio
con la forma ciclica. In presenza di un ossidante, il gruppo aldeidico si
ossida con formazione di acidi carbossilici detti acidi aldonici.
Gli agenti ossidanti
utilizzati sono il reattivo di Tollens (soluzione basica contenente ioni Ag+)
e il reattivo di Fehling (soluzione basica contenente ioni Cu2+),
che vengono ridotti a:
·
argento
metallico, che si deposita sulla parete della provetta formando uno specchio
d’argento
·
ossido di
rame, che precipita.
Ad esempio la reazione di
ossidazione del β-D-galattosio forma l’acido D-galattonico:
Un aldoso che reagisce con il reattivo di Tollens o di
Fehling viene detto zucchero riducente,
in quanto l’ossidazione del gruppo aldeidico è accompagnata dalla riduzione
degli ioni argento Ag+ o dagli ioni rame Cu2+.
FONTI del testo e delle immagini:
https://it.wikipedia.org/
www.treccani.it/
https://www.chimica-online.it
http://fco0809.blogspot.com
http://www.federica.unina.it
www.chimica.unipd.it/
Invito alla biologia.blu. di H. Curtis, N. S. Barnes, A. Schnek et al.
Chimica: concetti e modelli di Giuseppe Valitutti, Marco Falasca, Alfredo Tifi, Antonino Gentile.
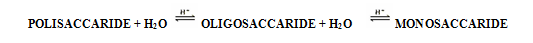










Commenti
Posta un commento